基于脱氧核糖核酸(DNA)与核糖核酸(RNA)的检查技术。在血液病患者的诊断和监测方面发挥着重要作用。
21世纪以来,关于血液系统良性和恶性疾病分子发病机制的认识获得巨大进展,使分子学检查常规用于血液学实验室,这些检查包括高敏感的聚合酶链反应(polymerase chain reaction,简称PCR)技术、数字PCR(digital PCR,简称dPCR)技术以二代测序技术等,其应用不仅对疾病的诊断、鉴别诊断、疾病状态和危险分层至关重要,而且还广泛用于微小残留病(minimal residual disease,简称MRD)检测、预后预测及治疗选择,对改善恶性血液病预后起到了积极作用。
PCR技术
PCR是一种分子生物学检查方法,应用这种方法可以使相同序列的DNA拷贝扩增成千上万倍。其原理是利用耐热DNA聚合酶通过温度循环复制DNA,加热是DNA双联分离、降温时进行DNA复制。PCR方法包括三个主要步骤:
①变性。95℃环境下大约1分钟的时间,此过程中DNA被加热,双链DNA解离成为可以与引物结合的单链,DNA模板的完全变性是PCR必需的,不完全变性会导致第一个循环扩增模板不能被有效利用,导致PCR产物形成不足。
②退火。45~60℃环境下大约1分钟左右的时间,此过程中引物与单链DNA的互补区域相结合,退火的温度比引物-DNA模板熔化的温度低5℃左右。如果非特异性PCR产物出现,可将退火温度增加1~2℃。
③延伸。72℃环境下大约1分钟左右的时间,此过程中Taq聚合酶通过识别靶序列,并通过添加核苷酸合成互补链,通常72℃环境下1分钟能合成PCR产物2Kb,如果扩增大的DNA片段,片段每增加1000bp延伸时间需要延长1分钟。在延伸阶段新合成的靶区域DNA作为模板,原有的DNA模板仍然存在直到反应结束。不过,数个循环结束后,新合成的DNA片段成为主要的模板。
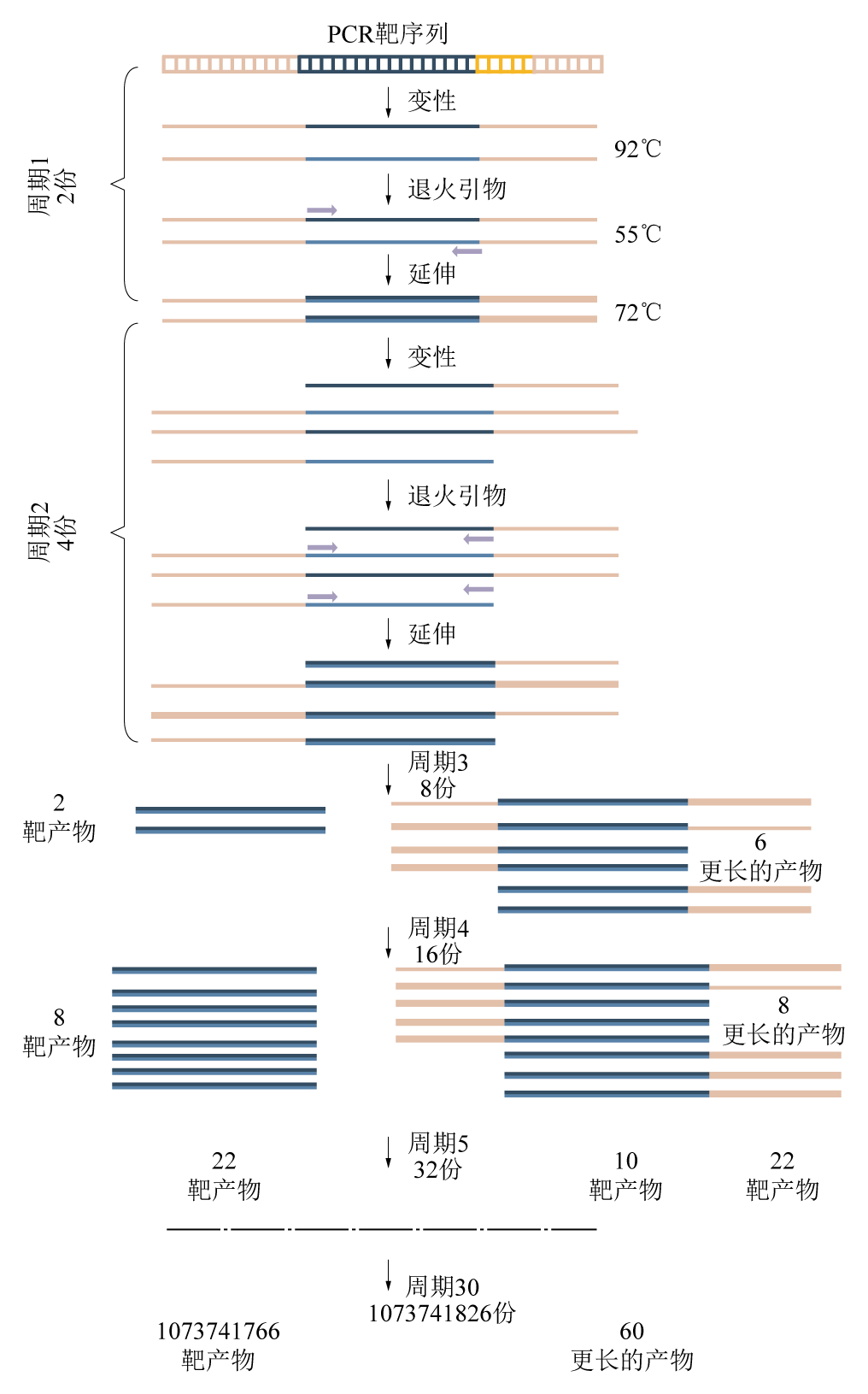
包括靶区域的双链DNA变性(denature),引物靶区域的两端退火,被Taq多聚酶复制形成两个拷贝,而后延伸、退火和延伸重复循环,30个循环后生成超过1010数量级的靶PCR产物。
PCR是一项非常敏感的技术,可以使靶DNA序列扩增百万倍,是血液系统疾病诊断和监测所必需的,以保证PCR技术敏感性,避免其他基因组DNA污染和假阳性,应该注意如下问题:
①DNA或RNA提取、PCR检测均应在独立的操作室进行,避免样本之间的污染。
②DNA或RNA提取区与PCR检测分析区的微量加样器应该分开。
③PCR检测应在配备紫外线灯的层流室进行,避免细菌生长。
④如果条件允许,应该配备高压蒸汽灭菌器。
⑤进行PCR操作时,应戴手套进行操作。
⑥除dDNPs外,所有溶液、引物、Taq聚合酶都应高压灭菌或紫外线照射。如果可能,各种溶液都应分装,并放置在指定的PCR操作区域。
⑦注意阴性和阳性对照的设置。
⑧不要打开装载扩增DNA的EP管,更不能把这些EP管再放回DNA/RNA提取区。
基于PCR技术的基本原理衍生出多种PCR技术,包括:
①等位基因特异性PCR。原理是用靶向包括已知的单核苷酸多态性或突变的探针检测基因JAK2V617F、KITD816V等。
②甲基化特异性PCR。主要用于评估CpG岛内CpG的甲基化状态;
③微卫星PCR。原理是围绕2、3、4或5个核苷酸重复序列进行扩增,主要用于嵌合体检测、区分不同个体等。
④多重PCR。指在单一的PCR反应体系下,应用多个引物同时检测靶基因的多个区域,可用于IG和TCR基因重排等。
⑤巢式PCR。指在两个连续的PCR扩增体系中应用两套引物,第一个扩增体系中的DNA产物作为第一个PCR扩增体系的模板。作为灵敏的MRD检测方法,不能定量,可用于基因BCR/ABL1、PML/RARA以及FIP1L1/PDGFRA等的检测。
⑥逆转录PCR。需要将RNA逆转录成cDNA后进行PCR扩增,可用于AML1/ETO等融合基因的检测。
⑦实时定量PCR。用于检测待测样本中的DNA、cDNA分子的定量测定,可检测基因BCR/ABL、WT1、PML/RARA等。
数字PCR技术
数字PCR技术于1999年问世,用于检测少见的突变、评估肿瘤组织和血浆DNA标本的等位基因失衡。意大利学者在一项研究中长期随访了17例接受异基因造血干细胞移植的急性髓细胞白血病(AML)患者,这些AML患者至少含有如下一种基因突变:DNMT3A R882H和R882C、IDH1 R132H和R132C以及IDH2 R140Q和R172K。移植后9例患者复发,比例达到53%,其中7例患者复发前至少一个时间点数字液滴PCR(ddPCR)检测阳性,提示复发预测敏感性为78%;8例无复发患者中,6例患者移植后不同时间点ddPCR检测均为阴性,提示复发预测特异性为75%。该研究提示,ddPCR可很好地用于AML患者DNMT3A、IDH1/IDH2突变的检测,用于MRD评估。此外,ddPCR还可用于IgH/TCR基因重排检测,评估急性淋巴细胞白血病治疗后的MRD。
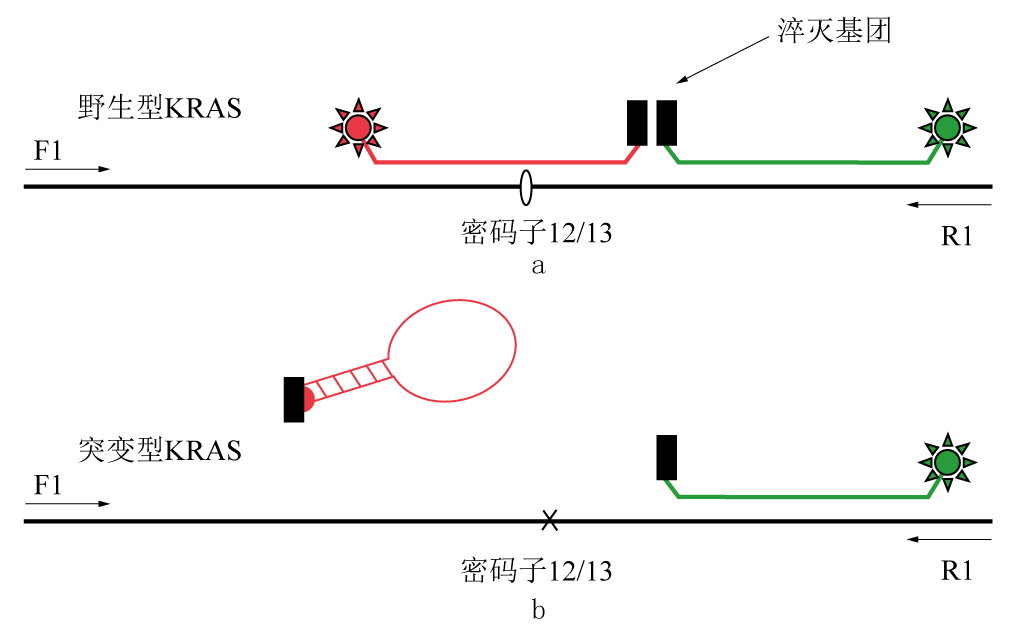
正向(F1)和反向(R1)引物扩增KRAS基因的外显子1包括相近的编码子12和13区域。非对称性扩增产生单链-DNA利用多余的R1引物与分子信标互补。绿色信标识别野生型和突变型的普通序列,而红色信标只识别野生型包括编码自12和13区域的序列。因此红色和绿色荧光在野生型DNA上均可被检出,而主要的绿色荧光由于不匹配的杂交在围绕编码子12和13的突变区域被检出。
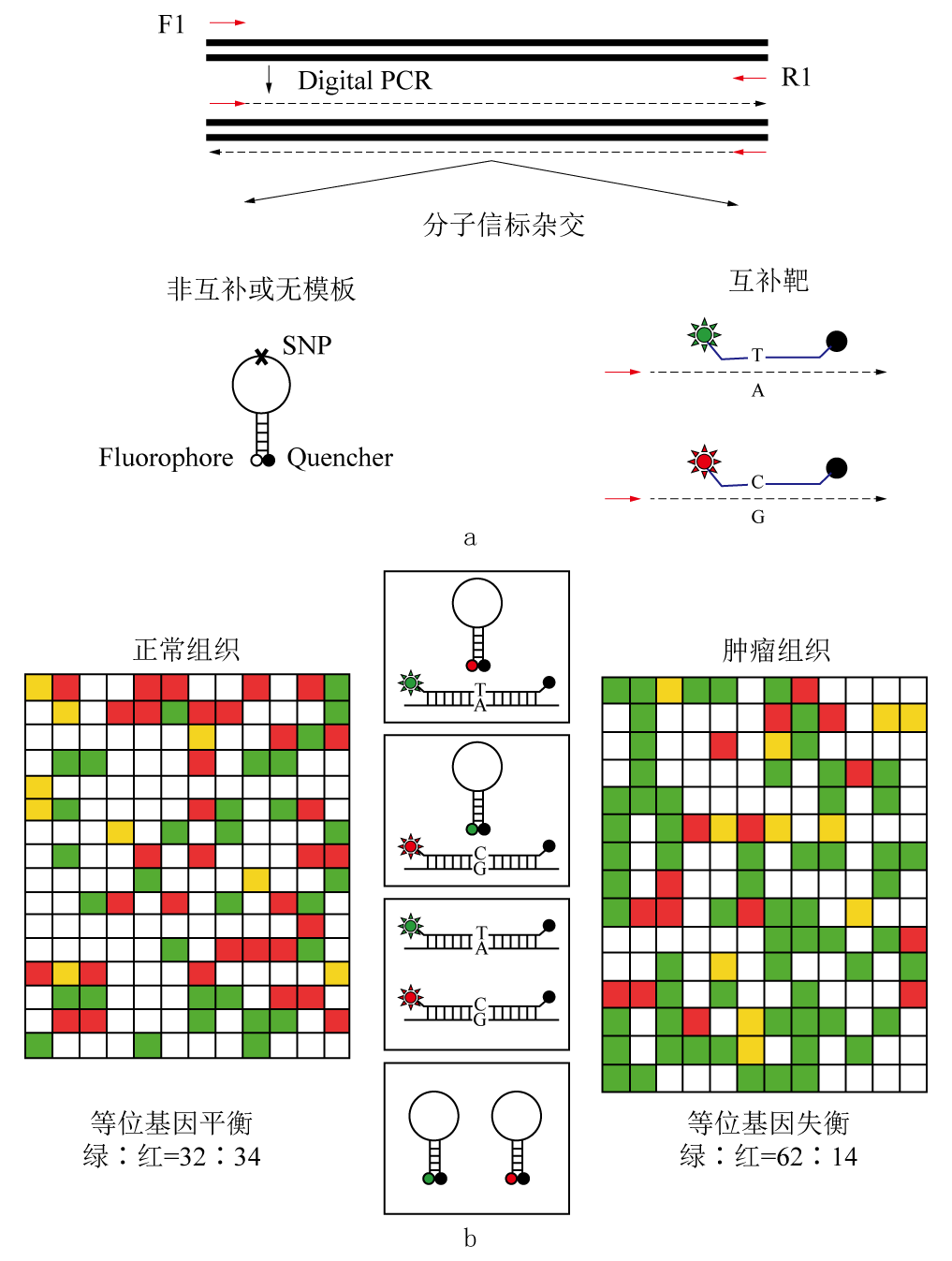
(A)分子信标设计。设计一对引物去扩增近100bp长的PCR产物,包括在中心区域的单核苷酸多态性(SNP)。利用两种信标去分析特异的SNP(其他序列均一致除了SNP的碱基配对)和荧光标记。绿色和红色分别代表fluorescein和hex标记。当分子信标没有与PCR产物杂交时并不发射荧光,因为3’端淬灭剂淬灭了信号。而当杂交到互补序列时,淬灭剂远离荧光集团,使得荧光增强。
(B)数字PCR分析简图。样本的DNA分布在384孔的PCR板中。完成PCR后,分子信标加入每个反应来决定等位基因状态。改良方案将使数字PCR和分子信标的等位基因测定在一步完成。
基因表达分析
基于微阵列的基因表达技术可同时检测细胞中成千上万的基因、蛋白表达,比较白血病细胞和正常细胞的基因表达谱,并用于白血病的分型。基因表达阵列的原理是标本中的核苷酸和基因特异核苷酸(探针)在实体支撑物(如玻璃)上进行杂交,生成靶核苷酸和单核苷酸或PCR产物,也可能是整个基因。标记荧光素的检测标本与互补系列结合后,发出可检测的荧光信号,信号强度与靶基因的量成正比。已有多种可从市场上获得的基因表达阵列技术用于临床和科研需要。以骨髓增生异常综合征(MDS)为例,基因表达阵列的应用如下:
①MDS患者的基因表达谱对AML转化具有高度的预测性。
②区别MDS患者与正常人骨髓CD34+造血干/祖细胞的基因表达谱。
③鉴别治疗相关MDS或伴有不同细胞遗传学异常的不同预后。
④基因表达谱检测可用于优化MDS的预后分层。
其他分子学技术
国内外学者已经建立了一系列分子学检查技术用于血液学肿瘤的评估,许多技术(如PCR、基因表达阵列等)成为临床诊断、预后评估和疾病检测的重要手段。其他分子学技术包括全基因组测序技术、寡核苷酸阵列分析单核苷酸多肽性和鉴定基因缺失、扩增区域以及杂合性、单亲二倍体等。将各种分子学检查技术合理用于血液病的诊疗在精准医学时代变得越来越重要,并成为实现个体化诊治的关键手段。
发表回复